您现在的位置是: 首页 > 录取信息 录取信息
高考化学氧化还原反应出现频率_高考化学氧化还原反应
tamoadmin 2024-05-23 人已围观
简介1.化学氧化还原反应配平 配平原则是什么2.高中化学的氧化还原反应3.化学高考:乙烯,KOH,SO2,苯这4种物质能因氧化还原反应而使溴水退色的是?4.一道高考的化学题谢谢~~5.高中化学 关于一个氧化还原反应方程式6.关于化学的氧化还原反应。7.高考化学6、(1)配平氧化还原反应方程式:__ C2O42-+__MnO4—考点阐释1.掌握氧化还原反应有关的概念。氧化还原反应的概念包括氧化和还原、氧
1.化学氧化还原反应配平 配平原则是什么
2.高中化学的氧化还原反应
3.化学高考:乙烯,KOH,SO2,苯这4种物质能因氧化还原反应而使溴水退色的是?
4.一道高考的化学题谢谢~~
5.高中化学 关于一个氧化还原反应方程式
6.关于化学的氧化还原反应。
7.高考化学6、(1)配平氧化还原反应方程式:__ C2O42-+__MnO4—
考点阐释
1.掌握氧化还原反应有关的概念。氧化还原反应的概念包括氧化和还原、氧化性和还原性、氧化剂和还原剂、氧化产物和还原产物等。命题多以选择题或填空题的形式出现。
2.综合应用化合价变化和电子转移的观点分析判断氧化还原反应中电子转移的方向和数目,配平氧化还原反应方程式。命题常以填空题的形式出现,有时还需要判断反应物或生成物。
3.会比较物质氧化性或还原性的强弱,其主要依据是:氧化(或还原)剂的氧化(或还原)性强于氧化(或还原)产物的氧化(或还原)性。
命题趋向与应试策略
(一)重视基础 形成知识规律
1.常见的氧化剂、还原剂
2.反应是否发生的规律
(1)强氧化剂与强还原剂相遇时,一般都会发生氧化还原反应。
如:H2SO4(浓)与金属,H2S、S2-、HI、HBr、I-、Br-、Fe2+、P。
Cl2与金属,H2S、S2-、HI、I-、HBr、Br-、Fe2+、P、H2、SO2、H2SO3、SO 。
HNO3与金属,H2S、S2-、HI、I-、HBr、Br-、Fe2+、P、SO2、H2SO3、SO 。
O2与金属,H2S、S2-、HI、I-、Fe2+、Si、P、H2。
(2)同种元素间不同价态相遇时,若无中间价态,不反应;若发生反应,则生成物中该元素价态必介于反应物中该元素两种价态之间。
如:H2SO4+SO2 不反应
H2S+SO2 只能生成S
ClO-+Cl- 只能生成Cl2
NH3+NO 只能生成N2
3.守恒规律
(1)原子个数守恒:反应前后同种元素的原子个数相等,这也是所有化学反应必须遵循的。
(2)电子守恒:失电子总数等于得电子总数,氧化还原反应才遵守且必须遵守。
(3)电荷守恒:反应前后离子所带正负电荷总数相等,离子方程式必须遵守。
4.氧化性或还原性强弱比较规律
(1)由元素的金属性或非金属性比较。
金属阳离子的氧化性随其单质还原性的增强而减弱,如下列四种阳离子的氧化性由强到弱的顺序是Ag+>Cu2+>Al3+>K+。
非金属阴离子的还原性随其单质氧化性的增强而减弱,如下列四种卤素离子还原性由强到弱的顺序是I->Br->Cl->F-。
(2)由反应条件的难易比较。
不同氧化剂与同一还原剂反应,反应条件越易,氧化性越强。如F2和H2混合在暗处就能剧烈化合而爆炸,而I2与H2需在不断加热的情况下才能缓慢化合,因而F2的氧化性比I2强。
不同还原剂与同一氧化剂反应,反应条件越易,还原性越强。如有两种金属M和N均能与水反应,M在常温下能与水反应产生氢气,而N需在高温下才能与水蒸气反应,由此判断M的还原性比N强。
(3)由氧化还原反应方向比较。
还原剂A+氧化剂B=氧化产物a+还原产物b,则:氧化性B>a,还原性A>b
如:由2Fe2++Br2===2Fe3++2Br-可知,氧化性Br2>Fe3+,还原性Fe2+>Br-。
(4)当不同的还原剂与同一氧化剂反应时,可根据氧化剂被还原的程度不同来判断还原剂还原性的强弱,一般规律是氧化剂被还原的程度越大,还原剂的还原性越强。同理,当不同氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。如氯气、硫两种氧化剂分别与同一还原剂铁起反应,氯气可把铁氧化为FeCl3,而硫只能把铁氧化为FeS,由此说明氯气的氧化性比硫强。
(5)某些氧化剂的氧化性或还原剂的还原性与下列因素有关:
温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
浓度:如浓硝酸的氧化性比稀硝酸的强。
酸碱性:如KMnO4溶液的氧化性随溶液酸性的增强而增强。
5.氧化还原反应方程式的配平方法技巧
(1)原则及顺序 ①电子得失守恒;②离子电荷守恒;③原子个数守恒。
(2)方法和技巧 ①顺配法:先从氧化剂或还原剂开始配平。适用范围:a.分子间的氧化还原反应;b.所有元素参与的氧化还原反应;c.生成物中物质既是氧化产物,又是还原产物。
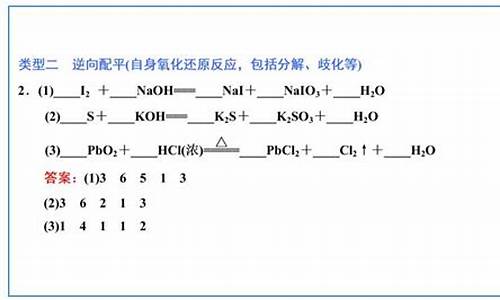
②逆配法:先从氧化还原反应产物开始配平。适用范围:a.自身氧化还原反应(含歧化反应);b.反应物中某一部分被氧化或还原。
(3)几类反应配平的技巧
①缺项类:a.可能缺的项:一般是反应介质,通常是酸、碱或水,它们参与反应,但其中元素化合价不变;b.确定方法:先配出氧化还原系数,后根据离子电荷守恒和原子个数守恒确定。
②多变类:a.有两种以上元素价态改变;b.存在一种物质,其中两种元素价态均同时升高或降低。
配平技巧:整体+零价法(即:把有多种元素价态改变的分子作为整体或把整体中各元素化合价当做0)。
如P+CuSO4+H2O H3PO4+Cu3P+H2SO4可看作:
根据电子得失相等,分别乘以系数5和6,合并得P原子总数,即可配平:
11P+15CuSO4+24H2O===6H3PO4+5Cu3P+15H2SO4
(二)分析热点 把握命题趋向
氧化还原反应在生产实践中应用极为广泛,它贯穿于中学化学的全过程,是高考命题的热点之一。在命题中经常涉及的知识及题型有:①从氧化还原反应的角度来分析反应类型;②判断化学反应中的氧化剂和还原剂、电子转移方向和数目;③比较氧化性或还原性的强弱,判断氧化还原反应的可能性及反应产物;④配平氧化还原反应方程式;⑤氧化还原反应的有关计算。
解答此类题目要注意从氧化还原反应的实质即电子转移入手去正确理解有关的概念,而在实际解题过程中,应从分析元素化合价有无变化及其升降这一氧化还原反应的特征入手。具体方法思路是:找变价、判类型、分升降、定其他。
氧化还原反应试题的解法规律性较强,也有一定的技巧,同时因涉及知识面广,会推出新的设问方式、新的题型,特别是与工农业生产、科研等实际相结合的知识,解题时要灵活作答。
[例题]在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2 KOCN+2KCl+H2O。被氧化的元素是___________。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:KOCN+KOH+Cl2 CO2+N2+KCl+H2O
(3)若处理上述废水20 L,使KCN完全转化为无毒物质。至少需液氯 g。
解析:本题结合含CN-的废水处理,考查氧化还原反应的基本概念、配平、标出电子转移的方向和数目,根据方程式进行定量计算,属中等题。何种元素价态升高谁即被氧化,不难分析。要配平方程式,同样从元素价态的升降、电子得失守恒考虑。标电子转移方向和数目可用单线桥或双线桥表示,但必须区分两者,第(3)题可根据两个方程式找出KCN与Cl2的总量关系求出。
(1)在KCN+2KOH+Cl2 KOCN+2KCl+H2O反应中,氯元素价态降低,H、N、O、K四种元素的价态没变,只有碳元素的价态升高,故被氧化的为碳元素。
(2)氧化还原方程式的配平,首先要找准变价元素,再利用化合价升降法配平,反应物KOCN中N的价态升高,KOCN为还原剂,氯气为氧化剂。
mol,由两步反应的化学方程式得出关系式:2KCN~5Cl2,所以需氯气:0.2 mol× =0.5 mol,即35.5 g。
答案:(1)碳(或C)
(3)35.5
化学氧化还原反应配平 配平原则是什么
HNO3浓的氧化产物是NO2,稀的是NO,这个只有记住了,大多数情况如此。不过有的时候题目会给出其他还原产物,到时候根据题设做题。
Cu与浓H2SO4,一个被氧化,一个被还原。
Cu+2H2SO4(浓)=加热=CuSO4+SO2↑+2H2O
2H2S+O2=2H2O+2S↓(点燃时O2不足或者缓慢氧化)
2H2S+3O2=点燃=2H2O+2SO2(点燃时氧气过量)
高中化学的氧化还原反应
氧化还原反应方程式的配平,是高考的重点,同时难度较大,需要认真把握,且勤加练习。那么,化学氧化还原反应怎么配平呢?下面我整理了一些相关信息,供大家参考!
如何配平氧化还原反应
氧化还原反应的基本原则是氧化剂得电子总数和还原剂失电子总数相等,即电子守恒原则,表现为化合价降低总数和升高总数相等。
有效的方法主要有两种:
一、根据氧化还原的特征配平(主要是电子守恒),适用于双元素氧化还原或歧化反应
1'根据氧化还原的元素配平 标出发生氧化还原的原子的前后化合价,用双线桥标明化合价升降数(即失得电子数),然后求最小公倍数,再用最小公倍数除以升降数,交换即得系数
2'根据氧化还原的分子配平 标出每个分子中元素化合价升降的代数和,求最小公倍数,除以代数和,交换即得系数
二、根据质量守恒定律配平(通法),但计算量大,通常只用于难配平的方程式
1'把各项的系数分别设为未知数,然后根据原子守恒列出方程组(一般是不定方程组),再把含最少未知数的关系式代入化学方程式,将系数化到最简
2'由于上一方法的计算量特别大,所以可以采取定“一”法 将第一项的系数定为一,然后对其他项的系数设元,列方程组求解,最后将系数化到最简
[注:对于反应物和生成物同的化学方程式,其配平的结果不一定是相同的]
氧化还原反应配平原则有哪些配平三原则:
1、得失电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高总数==化合价降低总数;
2、质量守恒:反应前后原子的种类和个数不变 ;
3.电荷守恒:离子反应前后,所带电荷总数相等。
氧化还原反应历程
氧化还原反应前后,元素的氧化数发生变化。根据氧化数的升高或降低,可以将氧化还原反应拆分成两个半反应:氧化数升高的半反应,称为氧化反应;氧化数降低的反应,称为还原反应。氧化反应与还原反应是相互依存的,不能独立存在,它们共同组成氧化还原反应。
反应中,发生氧化反应的物质,称为还原剂,生成氧化产物;发生还原反应的物质,称为氧化剂,生成还原产物。氧化产物具有氧化性,但弱于氧化剂;还原产物具有还原性,但弱于还原剂。
化学高考:乙烯,KOH,SO2,苯这4种物质能因氧化还原反应而使溴水退色的是?
1、之所以会有得失电子之说,解释起来是这样的:首先,原子是单独存在的最小结构(在化学范畴中)。原子由原子核、核外电子组成。核外电子在无时无刻地绕核运动,距核很远。当氯原子与钠原子相遇时,氯原子核中质子多,所以带正电荷大,对负电荷(即电子)吸引力大,所以钠原子最外层的一个电子受引力进入了氯原子的周围~电子得失,本质上是正负电荷相互吸引的过程^_^谁引力大,电子归谁~
2、如果该元素有升有降,那它既是还原剂,也是氧化剂。(这种反应,有一种专用名称,叫做歧化反应)。
3、至于这个问题= =应该是说反了。。高中课本上讲的是:氧化还原反应的本质是有电子的得失或转移。所以说,这是人为规定的。有电子得失的反应,才叫氧化还原~再解释一下就是:化学反应中,出现了一种现象,就是各种原子间可以相互转移电子,进而产生新的物质。这种现象呢,被人命名为氧化还原~
我今年刚刚高考完,621,理科生<有不懂的啥在我了解范围之内的,可以来问我^_^
一道高考的化学题谢谢~~
乙烯 为有机反应中的加成反应,非氧化还原反应;
氢氧化钾 是歧化反应,是氧化还原反应中的一种,方程式: 2KOH+Br2=KBr+KBrO+H2O
2KOH+3Br2=KBr+KBrO3+H2O
SO2 是氧化还原反应,方程式:SO2+Br2+2H2O=2HBr+H2SO4
苯 是萃取,利用 Br2 在苯中的溶解度大于在水中的,非氧化还原反应;
高中化学 关于一个氧化还原反应方程式
(1)有三个方程可以知道氧化性MNO4->CL2>2Fe3+>I2所以只有加Fe3+ 他只氧化碘离子而不会氧化氯离子
(2)将反应2和3“联立”:
2(Fe2+) + Cl2 = 2(Fe3+) + 2Cl-
扩大5倍,有:
10(Fe2+) + 5Cl2 = 10(Fe3+) + 10Cl-
跟反应3:
2(MnO4-) + 16(H+) + 10(Cl-) = 2(Mn2+) + 8H2O + 5Cl2
相加,消去两边相等部分,得到:
10(Fe2+) + 2(MnO4-) + 16(H+) = 2(Mn2+) + 8H2O
把这个称为反应4,它揭示了MnO4-和Fe2+在酸性条件下无法共存。
另外:
根据反应1,Fe3+跟I-无法共存;
由于Cl-和I-同属卤素离子,因此根据反应3,MnO4-在酸性条件下与I-无法共存。
搞清楚相互能否共存的关系之后,开始做题:
1、如果有I-,那么一定没有Fe3+和MnO4-,否则根据反应1和3而反应;
2、如果有Fe3+,也一样没有I-,否则根据反应1而反应,而其它两种离子之一可能存在;
3、Fe2+有剩余,就一定没有MnO4-,否则根据反应4而反应,其它两种离子之一可能存在;
4、MnO4有剩余,那么一定没有Fe2+和I-,否则根据反应3和4反应,而Fe3+可能存在。
关于化学的氧化还原反应。
C 被氧化生成大量CO2,溶于水是H2CO3;反应后是碳酸钾,这是刚好等比例量。如果生成的CO2在比比例量多一点而不是特别多,根据强酸制弱酸可以反应生成碳酸氢钾。(碳酸根强于碳酸氢根)
高考化学6、(1)配平氧化还原反应方程式:__ C2O42-+__MnO4—
H2O2这个物质很特别,其中-1价的氧既可以升到0价,有可以降到-2价,所以H2O2遇到强氧化剂显还原性,遇到强还原剂显氧化性。
具体这个反应要关注浓度的:当I2浓度大,HIO浓度小的时候,H2O2体现氧化性,把I2氧化为HIO;而随反应进行,HIO浓度增大、I2浓度减小到一定程度,H2O2就体现出还原性;这两个反应循环发生(可认为I2就是H2O2分解的催化剂)。
(2)溶液颜色由无色(原溶液的颜色)变成紫红色(高锰酸钾的颜色),由第一问可以算出25mL溶液中n(C2O4 2-)
(3)由质量守恒 n(H2C2O4·2H2O)+n(KHC2O4)=10n(C2O4 2-)
由中和反应中n(H+)=n(OH-):2 n(H2C2O4·2H2O)+n(KHC2O4)=0.005×10
剩下的自己算!









